이번에는 약물 전달 전략에 대해 이야기하고자 합니다. 이와 관련하여 소개 드릴 논문은 크게 네 편입니다. 이를 통해 약물 전달에 대해 더 넓은 이해가 가능할 거라고 생각합니다.
- Dai, Q. et al. (2018). ACS nano, 12(8), 8423-8435.
- Sindhwani et al. (2020). Nature materials, 19(5), 566-575.
- Kreyling, W. G. et al. (2015). Nature nanotechnology, 10(7), 619-623.
- Brownlee et al. (2018). Scientific reports, 8(1), 1-11.
Active Targeting은 알고 보면 허상인가?
첫 논문은 "Quantifying the Ligand-Coated Nanoparticle Delivery to Cancer Cells in Solid Tumors" (Dai, Q. et al.)입니다. 이 논문은 약물의 Passive Targeting 전략과 Active Targeting 전략의 실질적 효과에 대한 논문입니다. 그렇다면, Passive Targeting과 Active Targeting은 무엇인지부터 살펴볼 필요가 있습니다. Passive Targeting은 약물 표면에 타겟팅을 도와줄 화학적 작용기를 붙이지 않고 혈류 순환을 돌면서 자연스럽게 원하는 조직에 약물이 도달하도록 하는 전략을 말합니다. 가장 대표적으로 Enhanced Permeability Retention (EPR) 효과가 있습니다. 이것은 암 조직 주변의 혈관으로 신생 혈관이 많기 때문에 아직 성숙이 덜 이루어져 되게 Leaky하고 이로 인해 혈류 순환을 도는 약제들이 자연스럽게 암 조직으로 유입되는 효과를 말합니다. 한편, Active Targeting 전략은 약물 표면에 Active Targeting Moiety를 붙이는 것을 말합니다. 제가 소개 드린 논문에서는 다음과 같이 디자인입니다.
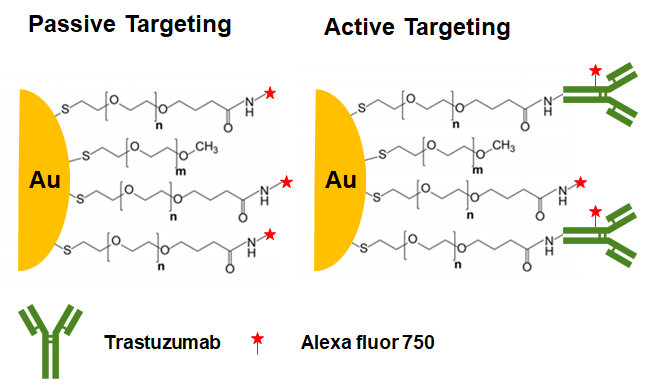
연구진들은 Flow Cytometry 등을 통해 제대로 위 작용기가 붙었다는 것을 확인했습니다. 여기서 Alexa fluor 750은 750 nm에서 형광 방출이 이루어지는 형광 염료라는 뜻입니다. 실제로 위와 같이 금과 실리카 나노입자를 만들고 마우스의 꼬리 정맥을 통해 입자를 주입해 보았습니다.
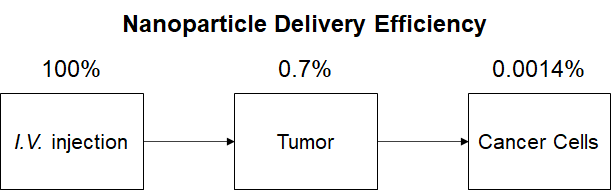
그러자 Active Targeting을 의도한 나노입자 100% 중에서 0.7%만이 종양에 도달하고, 다시 그 중에서 0.0014%만이 암 세포에 도달한다는 결론이 나왔습니다. 이 수치는 Passive Targeting과 크게 다르지 않은 수치였습니다. Active Targeting은 알고 보면 허상이라는 뜻인지가 문제가 됩니다. Active Targeting이 효과적이지 않은 이유로 이 연구진들은 암 조직 내외로 존재하는 대식세포인 Tumor Associated Macrophage (TAM)을 꼽았습니다. TAM은 주로 암 조직 내로 통하는 혈관 주변에 많이 분포한다고 합니다. 하지만 혈관 주변에 TAM이 전체적으로 둘러싸는 게 아니라 이 설명이 완전한가 하는 의문이 남는 것 같습니다.
Passive Targeting은 알고 보면 허상인가?
두 번째로 소개 드릴 논문은 "The entry of nanoparticles into solid tumours" (Sindhwani et al.)입니다. 방금 이야기 한 것과 정반대의 얘기를 하였습니다. 즉, 하나는 2018년에 나온 논문인데 Active Targeting을 반박하려고 하고, 다른 하나는 2020년에 나온 논문인데 Passive Targeting을 반박하려고 하는 상황입니다. 사실 이런 논의가 점점 더 심화되고 있는 것 같기도 합니다.
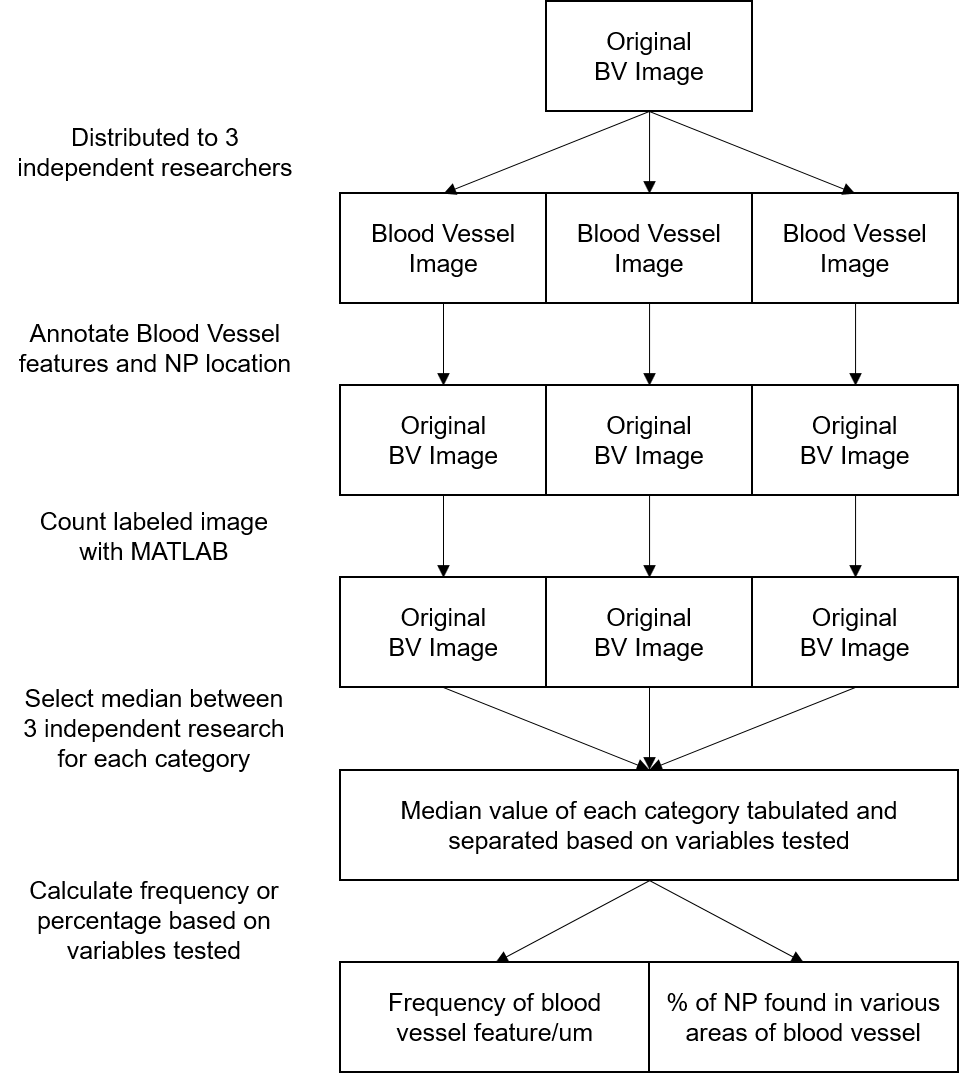
여기 논문에서는 TEM으로 일일히 금 나노입자의 개수를 세는 연구를 했습니다. 유량, 농도 등등을 다 계산해서 이게 물리 이론으로는 설명되지 않는다고 주장했습니다.
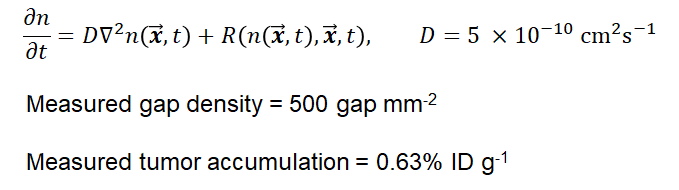
특히 농도와 관련해서 Fick의 법칙을 통한 물질전달 이론을 사용해서 시뮬레이션을 한 게 인상적이었습니다.
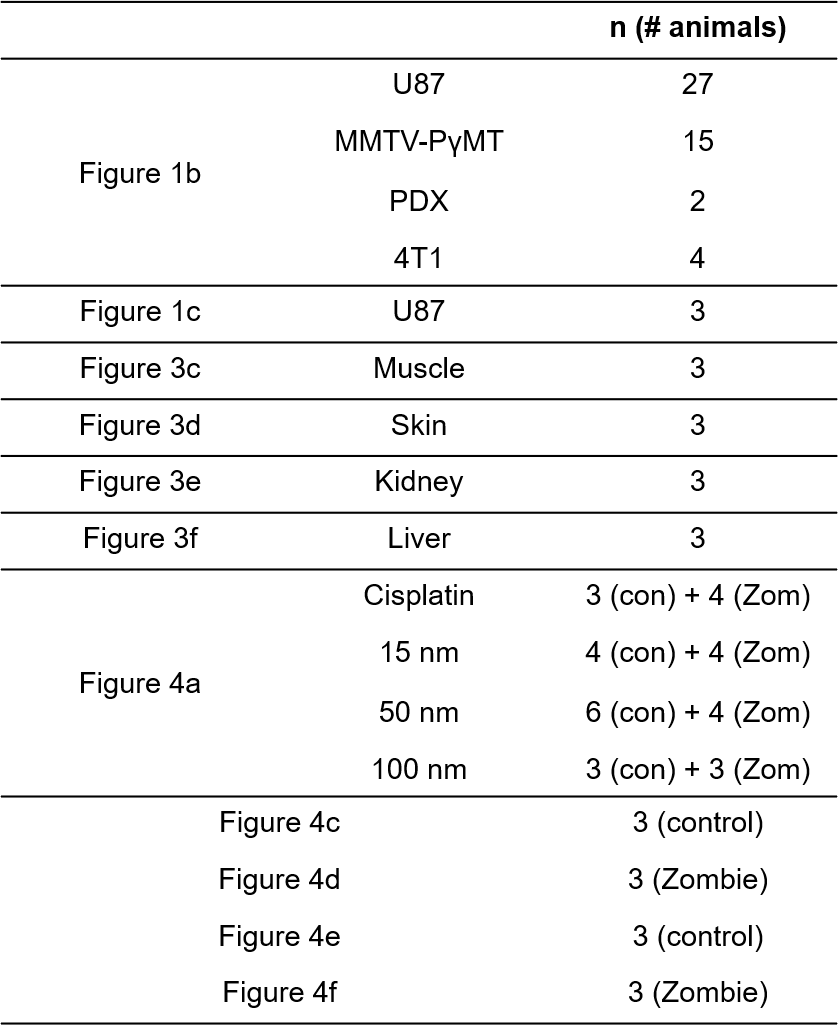
따라서 혈류 이동을 통한 Passive Pathway가 말이 안 된다고 주장합니다. 그렇다면 Active Pathway는 어떨까요? 여기서 Active Pathway의 효과를 평가하기 위해 좀비 모델이라는 동물 모델을 만들었습니다. 좀비 모델은 피 대신 고정액으로 마우스 몸 전체에 흘려 보내 생명활동을 정지시키고 Passive Pathway만 발생하도록 동물 모델을 만들어 봤습니다. 그러자 질량분석기로 나노입자의 양을 분석해본 결과 좀비 모델에서는 물질전달이 거의 일어나지 않았다는 게 밝혀졌습니다. 예를 들어, 50 nm 금 나노입자를 주입했을 때, 정상 마우스에서는 2.01% ID/g의 종양 내 침적이 관찰됐는데 좀비 마우스에서는 0.10% ID/g이 관찰됐습니다.
사실 좀비 모델이라는 게 혈관의 탄력성이나 세포 구조 같은 게 많이 보존이 안 됐을 거라 Passive Pathway조차도 제대로 가동되지 않은 게 아니냐는 반론이 있었습니다. 물론 Supplementary Material에서 이 연구의 정당성에 대해 상당히 길게 서술돼 있긴 합니다. 사실 현재에 이르러서도 이 문제에 있어서는 꾸준한 논의가 필요할 것 같습니다.
약물 전달 중에 일어나는 과정도 고려해야 합니다.
약물 전달이 어떤 경로로 일어나는지 뿐만 아니라 약물 전달 과정 중에 그 약물에 가해지는 변화에 대해 심도 깊은 논의가 필요할 것 같습니다. 약물 전달 과정 중에 일어나는 변화에 대한 논의는 꽤 최근까지도 이뤄지지 않았습니다. 그러다가 Radio-labeling Method 중 Direct Bombardment 방법이 개발되기 시작하고 약물 전달에 대한 이해가 늘어나면서 비로소 2015년에 "In vivo integrity of polymer-coated gold nanoparticles" (Kreyling, W. G. et al.)라는 논문이 나왔다고 판단합니다. 이 논문에서 대단한 기술적 진보가 있었다기 보다는 그 발견의 함의의 중요성 때문에 Nature nanotechnology (IF = 21.59)라는 꽤 높은 저널에 실렸다고 생각합니다.
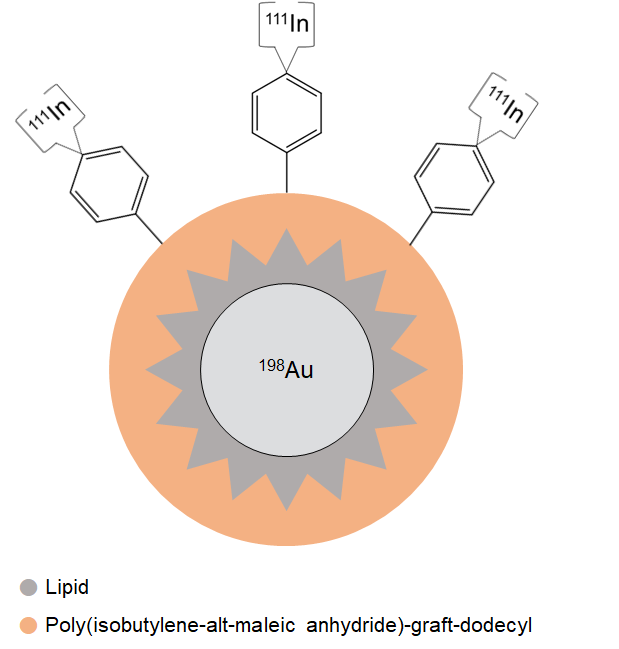
여기서는 금 나노입자 표면에 Organic Material로 Surface Coating을 하였는데, 이때 Core Metal과 Surface Coating Moiety를 서로 다른 방사선 동위원소로 표지하였습니다. 방사선 동위원소로 표지하는 방법은 (1) 배위결합을 통한 킬레이션, (2) Direct Bombardment, (3) 방사선 동위원소 전구체를 이용한 합성, 그리고 (4) 킬레이터를 통하지 않은 Post-synthetic Radiolabeling으로 구분되었습니다. (Sun, X. et al. (2015). Accounts of chemical research, 48(2), 286-294.) Surface Coating Moiety는 가장 많이 사용하는 방법은 킬레이션을 이용해서 방사선 동위원소로 표지하였습니다. 이에 반해 Core Metal은 최근 기술 발전에 힘입어 Direct Bombardment로 방사선 동위원소를 총알처럼 쏘아서 방사선 동위원소를 표지하는 방법을 사용했습니다. 이렇게 하면 서로 다른 두 동위원소각각의 위치를 ICP-MS로 알아낼 수 있습니다.
그 결과 강하게 결합하고 있을 것만 같았던 Surface Coating이 약물 전달 중에 분해가 된다는 게 발견됐습니다. 간단하게 요약하면, Au는 In보다 간, 비장, 폐, 뇌에 많고 신장, 자궁, 혈액, 대변, 오줌 등에 적었습니다. Au는 비교적 크기가 있는 나노입자로 간의 쿠퍼세포나 폐 모세혈관에 침적하는 경향이 강한 반면 여기로부터 분해돼 나온 작은 표면 유기분자 조각들이 체내 노폐물로 인식되어 배설되는 것이 관찰된 것입니다. 이로 인해 나노약이나 다양한 화학결합을 통해 완성된 Small Molecule Inhibitor, 생물학적인 복잡성을 반영한 Biologics 등이 체내에 전달될 때 쉽게 특정 구조가 분해되 나올 수 있다는 것을 암시합니다. 이런 것들이 예상치 못한 부작용 등을 낳을 수 있어서 완성된 약의 하나의 구조만을 볼 것은 아니고 전방위적으로 약의 분해나 변형 등을 고려할 필요가 있음을 시사한다고 봅니다.
한편, 뇌에도 0.01% 안팎의 비율로 나노입자가 간 것을 알 수 있는데 이는 조금 논란의 여지가 있다고 생각합니다. 아직까지 Blood-Brain Barrier (BBB)를 지나갈 수 있는 나노입자는 없다고 알려져 있습니다. BBB를 통과할 수 있는 건 Small Molecule Inhibitor라고 많은 것도 아니고, 포도당이나 코카인 등 극히 일부의 분자들만 통과할 수 있다고 알려져 있습니다. 저 나노입자가 BBB를 통과했는지 아닌지도 중요한 논의라고 할 수 있지만 BBB를 통과하여 현재 불치의 병이라고 알려진 퇴행성 뇌병변을 치료할 만한 실마리를 찾아야 할 것 같습니다.
아직도 약물 섭취에 대해 알려진 게 많지 않습니다.
사실 여러 논문을 찾아보면 약물이 전달되었다고 하더라도 그 약물 섭취 기전에 대하여 아직도 이해되지 않은 현상이 많은 것 같습니다. 네 번째로 소개 드릴 논문은 "Impact of the hypoxic phenotype on the uptake and efflux of nanoparticles by human breast cancer cells" (Brownlee et al.)입니다. 여기에서는 저산소증 환경이 나노입자의 섭취를 증가시켰다는 연구입니다. 도대체 어떤 기전이 있어 이런 세포 배양 환경이 약물 섭취에 영향을 주는지 알려지지 않았던 거 같습니다.
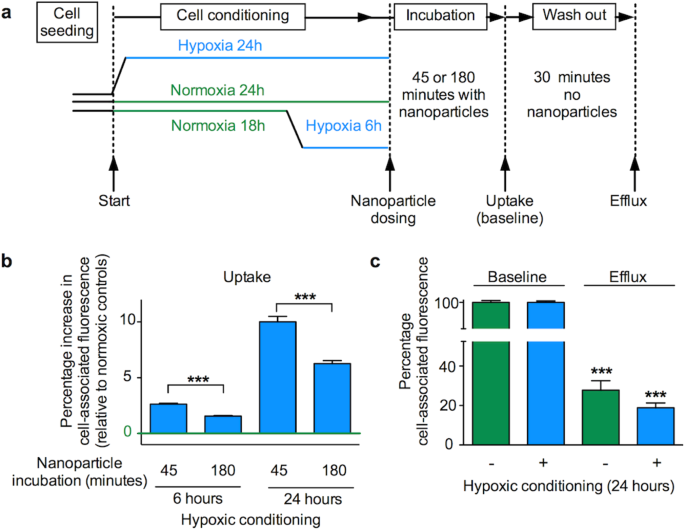
약물 전달은 약물의 효과에 가장 중요한 요소라고 할 수 있습니다. 이렇게 아직 알려지지 않은 부분이 많다는 것은 아직 연구할 것도 많다는 뜻인 거 같습니다. 이런 잘 알려지지 않은 부분이 모두 밝혀진다면 더 안전하고 효과적인 약물 개발이 가능할 것 같다는 기대가 듭니다.
이상 포트래이 tech 블로그였습니다.






